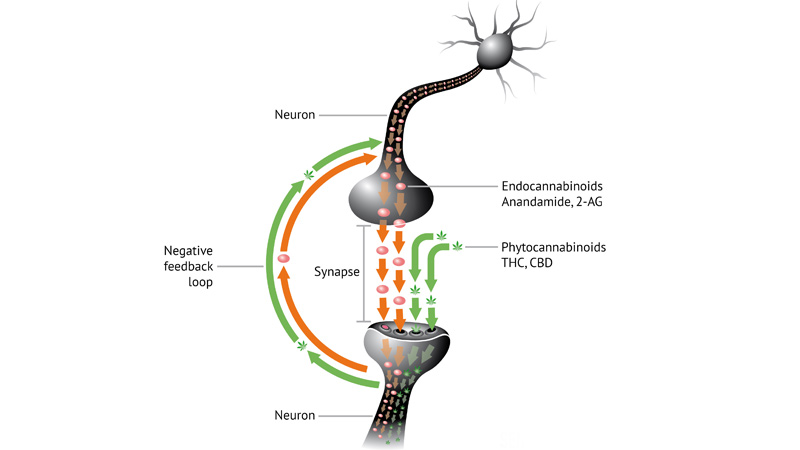
Endokannabinoidy – funkcje w ciele człowieka
Powszechnie wiadomo, że konopie potrafią naśladować pewne substancje w ciele człowiek. Omówimy przegląd najważniejszych produkowanych przez człowieka neuroprzekaźników kannabinoidowych. Dowiemy się jakie są najważniejsze role endokannabinoidów i jak dzięki nim można leczyć szereg dolegliwości.
Głowne endokannabinoidy
Neuroprzekaźniki pełnią niezwykle istotną rolę w układzie nerwowym człowieka. Są niezbędnym elementem prawidłowego funkcjonowania poszczególnych układów oraz mają kluczowe znaczenie w kontekście holistycznego utrzymania homeostazy organizmu. Najbardziej poznanymi endokannabinoidami na tą chwilę są:
- anandamid (AEA),
- 2-arachidonylo-glicerol (2-AG),
- eter noladyny (2-AGE),
- wirodhamina,
- n-arachidonylo-dopamina (NADA),
- n-arachidonylo-glicyna (NAGLy),
- oleamid (ODA),
- oleoiloetanoloamid (OEA),
- steraoiloetaloamid (SEA),
- palmitoiloetonaloamid (PEA),
- szereg innych pochodnych etanylamidowych kwasów tłuszczowych określono jako potencjalne endokannabinoidy, jednak w niedostatecznym jeszcze stopniu.
Nie trudno sobie wyobrazić jak złożoną maszynerią jest układ endokkannabinoidowy i wpływ kannabinoidów jako neuromediatorów na receptory nerwowe. Sposób wytwarzania i dalszego metabolizmu endokannabinoidów odbywa się na drodze skomplikowanych procesów biochemicznych.
Zadanie endokannabinoidów
Pierwsze odkrycie endokannabinoidów pozwoliło otworzyć nowy rozdział i zrewolucjonizowało medycynę. Badania naukowe są bardzo wszechstronne tematycznie, gdyż odkrywa się coraz więcej istotnych zależności między kannabinoidami i procesami zachodzącymi we wszystkich komórkach naszego ciała. Obecne badania skupiają się również na tym jak waha się poziom poszczególnych endokannabinoidów w odpowiedzi na różne stany chorobowe. Wytwarzanie endokannabinoidów stanowi jeden z wielu rozbudowanych mechanizmów reakcji obronnych i sygnalizacji wewnątrzkomórkowej i wewnątrzustrojowej.
Na przykład: uaktywnienie enzymu fosfolipazy D, C i uwolnienie kwasu arachidonowego oraz innych kwasów tłuszczowych z lipidów błon i struktur komórkowych następuje pod wpływem bodźców fizycznych lub poprzez pobudzenie szeregu receptorów: muskarynowych, noradrenergicznych, glutaminergicznych i wielu innych. Wytwarzanie jest proporcjonalne do siły bodźca (śródkomórkowy wzrost stężenia jonów wapnia lub pobudzenie metaboreceptorów glutaminianowych), a stężenie stanowi wypadkową enzymatycznej syntezy i rozkładu odbywających się z wykorzystaniem kilku szlaków metabolicznych. W rozkładzie endokannabinoidów uczestniczą między innymi hydrolazy, jak hydrolaza amidów kwasów tłuszczowych (FAAH), rozkładająca 2AG lipaza monoacyloglicerolu (MAGL) oraz oksygenazy lipidowe i cyklooksygenazy. Cyklooksygenaza COX-2 jest wspólnym enzymem w szlaku przemian endokannabinoidów i prostaglandyn, który do prostaglandyn metabolizuje głównie kwas arachidonowy, ale także anandamid i inne etanolamidy tłuszczowe. Co z tego wynika? Zwiększoną aktywnością FAAH w płytkach krwi kobiet chorujących na migrenę tłumaczy mniejsze stężenia kanabinoidów i większą częstość występowania bólów migrenowych. Zaburzenia homeostazy endokannabinoidowej skutkuje szeregiem patologi w obrębie ośrodkowego i centralnego układu nerwowego (ciało, mózg).
Anandamid AEA
Zauważono, że produkcja tego endokannabinoidu zwiększa się przy pewnych stanach chorobowych. Organizm wydziela więcej tej substancji w odpowiedzi na stany zapalne, szczególnie stawów, wątroby i jelit gdzie obwodowe receptory CB1, na które reaguje są bardziej skoncentrowane. W mózgu te receptory zajmują główne miejsce, dlatego anandamid jest skoncentrowany głównie w centralnym układzie nerwowym. Tutaj zwiększone stężenie obserwuje się przy chorobie Alzheimera, epilepsji i innych zaburzeń neurodegradacyjnych oraz psychicznych.
2-arachidonylo-glicerol (2-AG)
Endokannabinoid silnie skoncentrowany w mózgu. Może go być nawet 800 razy więcej niż AEA. Te wewnętrzne kannabinoidy mogą się metabolizować na drodze wielu szlaków enzymatycznych. Nie zagłębiając się w chemiczny dialekt procesów na drodze, których powstaje i jego przemian, wykazuje silne działanie apoptozowe kiedy aktywuje receptory CB1.
Indukcja śmierci komórek jest związana ze zmianami morfologicznymi, takimi jak kondensacja chromatyny, fragmentacja DNA oraz zmianami metabolicznymi wynikającymi ze wzrostu aktywności kaspazy w różnych miejscach nowotworowych komórek.
Oleamid (ODA)
Określany czasem jako cerebrodien, jest silnym aktywatorem receptorów CB2 oraz wykazuje lekkie działanie na receptory CB1. Koncentruje się silniej w mózgu w stanach zmęczenia i zaczyna się wydzielać już po kilku godzinach po przebudzeniu. Skraca czas potrzebny do zaśnięcia oraz wydłuża poszczególne fazy snu. Poznano również wpływ na grupę receptorów serotoninowych 5-HT2, a działając synergistycznie na inne neuroprzekaźniki aktywujące te receptory.
Obecność oleamidu w organizmie człowieka wpływ na stany lękowe i depresyjne nie tylko pobudzając ośrodki serotoninowe. W podobny sposób jak na receptory 5-HT2, oleamid wpływa na receptory GABA(A). Sam nie aktywuje jego receptorów, ale nasila działanie ich postsynaptyczne, które jest wywoływane przez inne substancje aktywujące ten typ receptorów GABA. W analogiczny sposób wpływa też na receptory glicyny – drugich, zaraz po po GABA neuroprzekaźnika hamującego stres i mającego kluczowe znaczenie w odprężeniu i regeneracji organizmu… zwłaszcza w trakcie snu.
To nie wszystko. Ten amid kwasu tłuszczowego wykazuje działanie, takie jak konopie! Aktywowane są oba typy – CB1 i CB2. Dzięki aktywacji CB2, oleamid wykazuje działanie przeciwzapalne, podobnie do kannabidiolu. CB1 jest aktywowany z mniejszą mocą, ale jednak jest. Ten typ receptora jest odpowiedzialny za psychoaktywne działanie marihuany, a w szczególności działanie nasenne, co mocno uzupełnia profil działania oleamidu.
Terapie konopne
Dzisiejsze badania pozwoliły zrozumieć działania poszczególnych kannabinoidów z tej rośliny. Wykazują identyczne działania jak te substancje, które człowiek sam wytwarza w swoim organizmie. Nie trudno się domyśleć, że zainteresowało to specjalistów nad wykorzystaniem konopi lub związków z tej rośliny w terapiach leczenia wielu poważnych schorzeń, które często są odporne na leczenie farmakologiczne. W dobie dzisiejszego rozwoju medycyny jesteśmy w stanie już w taki sposób dobierać preparaty z konopi, aby jeszcze skuteczniej wykorzystać zdrowotne działanie tej rośliny. Niewątpliwie konopie są rośliną przyszłości, która nada, a właściwie już nadaje, nowe kierunki w medycynie.
Źródło:
- Rola układu kannabinoidowego w patogenezie oraz poszukiwaniu nowych możliwości farmakoterapii zespołu zależności alkoholowej,
- akademiamedycyny.pl,
- Postępy Higieny i Medycyny Doświadczalnej.